Una base o álcali (del árabe: Al-Qaly القلي ,القالي, 'ceniza') es cualquier sustancia que presente propiedades alcalinas. En primera aproximación (según Arrhenius) es cualquiersustancia que en disolución acuosa aporta iones OH− al medio. Un ejemplo claro es el hidróxido potásico, de fórmula KOH:
- KOH → OH− + K+ (en disolución acuosa)
Los conceptos de base y ácido son yuxtapuestos. Para medir la basicidad (o alcalinidad) de un medio acuoso se utiliza el concepto de pOH, que se complementa con el de pH, de forma tal que pH + pOH = pKw, (Kw en CNPT es igual a 10−14). Por este motivo, está generalizado el uso de pH tanto para ácidos como para bases.
Índice
[ocultar]Distintas definiciones de base[editar]
La definición inicial corresponde a la formulada en 1887 por Svante August Arrhenius.
La teoría ácido-base de Brønsted-Lowry, formulada por Brønsted y Lowry en 1923, dice que una base es aquella sustancia capaz de aceptar un protón (H+). Esta definición engloba la anterior: en el ejemplo anterior, el KOH al disociarse en disolución da iones OH−, que son los que actúan como base al poder aceptar un protón. Esta teoría también se puede aplicar en disolventes no acuosos.
Lewis en 1923 amplió aún más la definición de ácidos y bases, aunque esta teoría no tendría repercusión hasta años más tarde. Según la teoría de Lewis una base es aquella sustancia que puede donar un par de electrones. El ion OH−, al igual que otros iones o moléculas como el NH3, H2O, etc., tienen un par de electrones no enlazantes, por lo que son bases. Todas las bases según la teoría de Arrhenius o la de Brønsted y Lowry son a su vez bases de Lewis.
- Ejemplos de bases de Arrhenius: NaOH, KOH, Al(OH)3.
- Ejemplos de bases de Brønsted y Lowry: NH3, S2−, HS−.
Propiedades de las bases[editar]
Finalmente, según Boyle, bases son aquellas sustancias que presentan las siguientes propiedades:
- Poseen un sabor amargo característico.
- Sus disoluciones conducen la corriente eléctrica.
- Cambian el papel tornasol rojo en azul.
- La mayoría son irritantes para la piel (cáusticos) ya que disuelven la grasa cutánea. Son destructivos en distintos grados para los tejidos humanos. Los polvos, nieblas y vapores provocan irritación respiratoria, de piel, ojos, y lesiones del tabique de la nariz.
- Tienen un tacto jabonoso.
- Son solubles en agua (sobre todo los hidróxidos).
- Reaccionan con ácidos formando sal y agua.
Fuerza de una base[editar]
Una base fuerte es la que se disocia completamente en el agua, es decir, aporta el máximo número de iones OH−. El hidróxido potásico es un ejemplo de una base fuerte.
Una base débil también aporta iones OH− al medio, pero está en equilibrio el número de moléculas disociadas con las que no lo están.
En este caso, el hidróxido de aluminio está en equilibrio (descomponiéndose y formándose) con los iones que genera.
Formación de una base[editar]
igual es:
Nomenclatura de bases[editar]
Para crear una base usando diversas nomenclaturas para ellas tomadas a partir de los nombres de los elementos y juntándolos con un ion hidroxilo (OH), tomando el número de valencia del elemento y combinarlos (cambiándolos de posición) como se muestra en la tabla:
| Fórmula | Tradicional | Stock | IUPAC |
|---|---|---|---|
| Cu(OH) | Hidróxido cuproso | Hidróxido de cobre (I) | Monohidróxido de cobre |
| Cu(OH)2 | Hidróxido cúprico | Hidróxido de cobre (II) | Dihidróxido de cobre |
Cuando un elemento tiene más de dos valencias no se le pone nomenclatura tradicional. Al usar la menor valencia, el elemento termina en oso y cuando se usa la mayor termina en ico. En la nomenclatura IUPAC se le va a dar una conformación de prefijos al elemento según su valencia usada (Mono, Di, Tri, Tetra, Penta, Hexa, etc) junto con la terminación -hidroxi u -oxidrilo que es el ion OH con carga −1.
Ejemplos de bases[editar]
Algunos ejemplos de bases son:
- Sosa cáustica (NaOH)
- Leche de magnesia (Mg(OH)2)
- El cloro de piscina (hipoclorito de sodio)
- Antiácidos en general
- Productos de limpieza
- Amoníaco (NH3)
- Jabón y detergente
- Bicarbonato de sodio
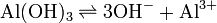

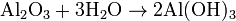

No hay comentarios.:
Publicar un comentario